【第7回】色素体分裂リング本体の遺伝子の同定と機能解析
吉田大和1・黒岩晴子1・河野重行2・黒岩常祥1(1立教大・RICE,2東京大・院・新領域・先端生命)
地球上の多くの生物が、酸素・食料・エネルギーなどを植物の葉緑体(色素体)の光合成活動に依存して生きている。色素体は細胞内でゼロから作られることはなく、既存の色素体の分裂によってのみ増殖する。しかしそれらの分裂増殖機構は長い間明らかでなかった。1986年に、黒岩らによる電子顕微鏡観察によって色素体の分裂面に特殊なリング構造が発見され、色素体分裂リング(Plastid-Dividing ring; PDリング)と名付けられた。その後研究が進み、色素体は、PDリングを中心に複数のタンパク質が結合した色素体分裂装置(PD machinery)によって分裂増殖していることが分かってきた。現在では、色素体の分裂増殖機構は原始紅藻から高等植物に至るまで普遍性が高いことが明らかとなってきており、その分子生理機構の全貌解明が急務となっている。特に色素体分裂装置の主要構造物であるPDリングは幅7ナノメートルの極細な繊維からなるが、それらを構成するタンパク質やその遺伝子は、いまだ完全には同定されていなかった。
このような色素体の分裂増殖機構を解明するため、我々の研究グループを中心として、原始紅藻シゾン(Cyanidioschyzon merolae)を研究材料として開発し、次のような様々な解析手法・技術の開発を行ってきた(図1A)。
(1) シゾンは、最少数の細胞小器官を含み、1細胞あたり1個の細胞核、1個のミトコンドリア、1個の色素体を含んでいる。12時間毎の光の明暗周期で細胞を同調培養し、色素体分裂を同調的に行うことができる。
(2) 色素体の分裂装置が植物の中でも特に大きい。
(3) ゲノムプロジェクトの結果、100%の解読率で塩基配列が決定された唯一の真核生物であり、全遺伝子(4775遺伝子)が明らかになっている。ゲノミクスやプロテオミクスによる解析が可能である。
(4) アンチセンス法による遺伝子ノックダウン解析や相同組み換え法による遺伝子ノックアウト解析等、様々な遺伝子破壊・操作技術が可能である。
|
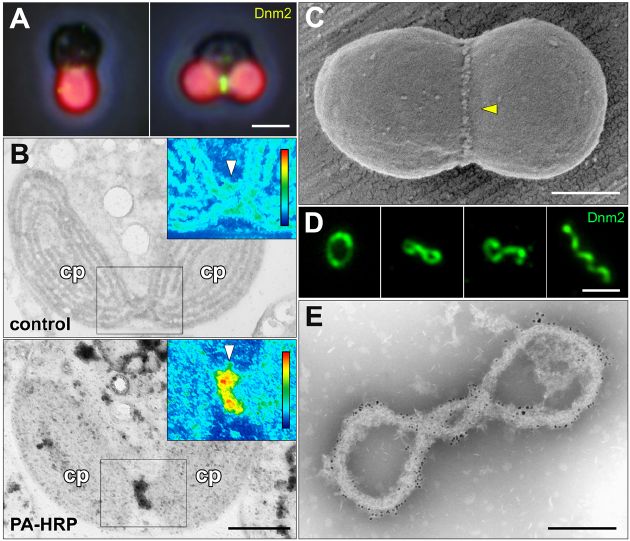
我々が単離した色素体分裂装置を様々なタンパク質分解酵素で処理しても、全てを分解することが出来なかった。このためPDリングの構成物としては、タンパク質以外の物質が考えられた。そこで、今回我々は様々な分析を行って構成物質を探索した結果、糖特異的電子顕微鏡法(PA-HRP法)によって色素体分裂面に非常に強いシグナルを得ることができた(図1B)。この結果からPDリングの主構成物質として、糖の存在が示唆された。次に我々はシゾンの大量高度分裂同調培養系を開発し、細胞分画を行うことによって無傷な分裂期色素体を大量に単離した(図1C)。次にこれを非イオン性界面活性剤Nonidet P-40で処理することによって、色素体の膜系内容物を除去し、更に別種の非イオン性界面活性剤Octylglucosideによる処理によって色素体包膜を溶解することで、無傷な色素体分裂装置画分を得ることに成功した(図1D,E)。次にグラジェントゲルを用いて色素体分裂装置を無傷に単離し、そのプロテオミクスを行った。その結果、糖の合成に関わるグリコシルトランスフェラーゼドメインを持つ新規の遺伝子PDR1(遺伝子名の詳細は後述)が見つかった。シゾンの細胞周期に応じた発現量の変化を調べるため全遺伝子のマイクロアレイ解析を行い、さらに抗PDR1抗体を作製してタンパク発現を調べた結果、PDR1は色素体分裂期に特異的発現をするタンパク質であることが明らかになった。
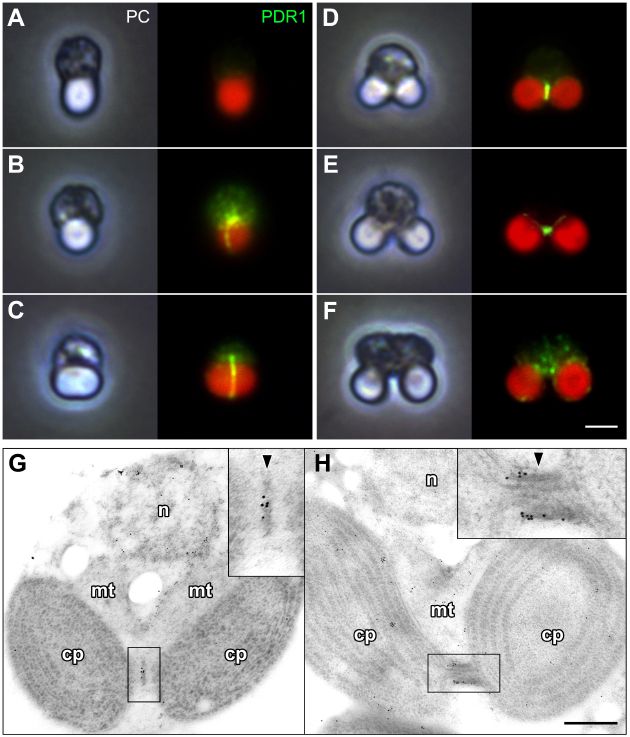
そこで次に間接免疫蛍光法による解析を行ったところ、PDR1は色素体分裂面にリング構造を形成していることが明らかになった(図2)。また、免疫電子顕微鏡法による詳細な局在解析を行ったところ、PDリングの上に共局在していることが分かったため、この遺伝子をPDリング遺伝子(plastid-dividing ring 1;PDR1)と名付けた。また愛称を「KUSANAGI」とした。
|
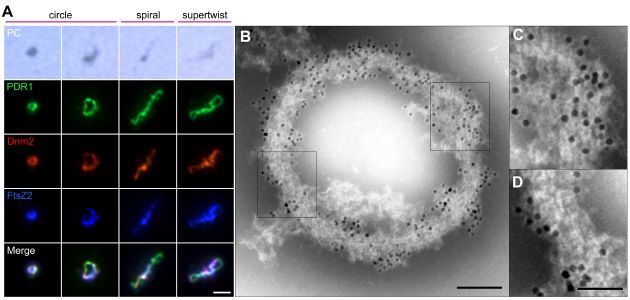
単離した色素体分裂装置におけるPDR1タンパク質の局在を詳しく調べたところ、PDR1の局在を示す免疫電子顕微鏡像ではPDR1を示す金コロイド粒子が分裂装置全体に渡って存在することを示した(図3A,B)。また、PDリングの繊維束が少し崩れた箇所を調べた結果、PDR1タンパク質が繊維束内部にも存在することが分かった(図3C,D)。
|
そこで次に、PDR1タンパク質と糖物質との関連を調べるための幾つかの生化学的解析を行ったところ、PDリング繊維は、PDR1タンパク質を基点として、グルコースが多数連なったポリグルカンから構成されていることが明らかになった。
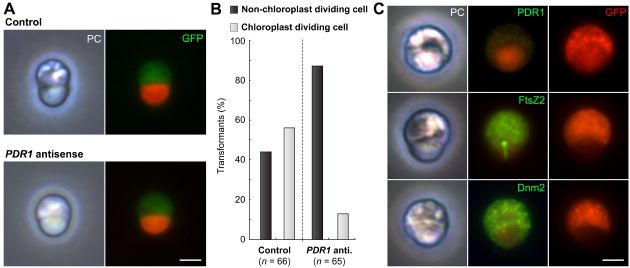
また、アンチセンス法によるPDR1遺伝子の発現抑制解析を行ったところ、PDR1遺伝子が色素体分裂に必須の遺伝子であることが分かった(図4)。
|
今回の研究によって、遂に色素体分裂増殖機構の全貌解明の糸口が得られたと考えられる。PDR1の遺伝子構造に含まれているグリコシルトランスフェラーゼドメイン自体は一部のバクテリアも保持している。このため原始的な真核生物が共生により取り込んだシアノバクテリアを色素体に変換する際、バクテリア由来のグリコシルトランスフェラーゼ遺伝子を改変し、色素体の分裂増殖を制御するために創り出した遺伝子ではないかと考えられる。また、これまで多糖から構成されるポリマー構造が細胞内骨格に似た役割を果たすことは全く知られていなかったため、今後の研究の展開は色素体分裂機構だけではなく、様々な細胞内分子メカニズムの研究にも大きな影響を与えると予想される。更に、色素体分裂装置に類似の構造はミトコンドリアや脳のシナプシス小胞形成の際にも見られることから、細胞小器官誕生の基本機構が明らかになると期待している。単離した色素体分裂装置の免疫電子顕微鏡像はサイエンス誌の表紙を飾った。
|
記事・写真・図版などの無断転載を禁じます。