【第11回】海洋性珪藻における無機炭素獲得系とCO2固定
菊谷早絵・中島健介・松田祐介(関西学院大学・理工学部・生命科学科)
1. はじめに
海洋性珪藻類は地球上の一次生産の約20%を担っていることが、近年の人工衛星によるリモートセンシングと大規模な海洋調査によって明らかになっており、海洋における炭素循環のみならずケイ素やその他の微量金属などの物質循環に極めて重要な役割を負う生物であることが指摘されています。このような生物の環境変動下における細胞生理の応答や群集の消長は地球レベルの環境変動予測に直結する情報となる可能性がありますが、細胞内でどのような分子がどのように働いているのか、という基礎的知見はあらゆるレベルで詳しくは分かっていません。独立栄養生物の基本的な代謝としては光合成がまずあげられますが、これは光、温度、二酸化炭素や酸素などの溶存ガス分子、窒素や硫黄などの主無機栄養、および鉄や亜鉛などの微量栄養などの様々な環境因子の影響下にあります。水中ではCO2の溶存量は非常に低く、また溶存分子の拡散速度がガス分子の10-4であることから、光合成生物はCO2獲得に何らかの積極的なシステムを必要とします。特に海洋のような高塩・高アルカリ環境下では、さらにCO2獲得が困難となりますが、このような環境においても海洋性珪藻類は、CO2に対して高親和性光合成を行い、高い一次生産力を誇っています。これは、海洋性珪藻類がCO2濃縮機構 (CO2-concentrating mechanism: CCM) を有しているからです。CCMは恐らくほとんどの藻類が進化した後に、大気組成の変化を受けて獲得されたもので、その起源は3-4億年前にさかのぼると考えられています。そのためCCMは広範な収斂進化の賜物であり、従って、これにかかわる分子はかなり多様であると考えられますが、淡水性のシアノバクテリアや緑藻クラミドモナスで詳しく調べられている分子機構を紐解くと、CCMは本質的に大きく2つのステップから成ると考えられます。1つめは、細胞膜上に存在する無機炭素輸送体によって細胞外から能動的に無機炭素を取り込むステップで、2つめは、取り込んだ無機炭素の漏れ出しを防ぎながらCO2へと変換し、効率良く炭酸固定化酵素ribulose-1,5-bisphosphate carboxylase/oxygenase (RubisCO)へと供給するステップです。珪藻類は2億5千万年前に現れ始めた最も新しいCCM生物と考えられ、その多様な細胞や葉緑体のサイズおよび形態から、ユニークなCCMを有しているものと考えられます。今回は、海洋性珪藻類のCCMにおける上記2つのステップに関わる私たちの最近の研究成果を紹介したいと思います。
2. 珪藻の進化と葉緑体構造
珪藻は二次共生によって成立した生物です。シアノバクテリアが真核従属栄養細胞に共生することによって、植物や緑藻、紅藻の起源となる始原植物細胞が誕生しました。珪藻類は、こうして誕生した紅藻がさらに真核従属栄養細胞に共生することによって成立したと考えられています (図1A)。二次共生の過程を経て成立した珪藻の葉緑体は、その構造も複雑化して4重膜構造を有しています (図1B)。外側2膜は葉緑体小胞体(CER)、内側2膜は葉緑体包膜と呼ばれます。CERの外側の膜は核膜と融合しており、核葉緑体連合を形成しています。さらに葉緑体内には、ピレノイドというRubisCOを多量に含むタンパク質顆粒が存在します。また珪藻ゲノムの詳細な解析から、珪藻葉緑体で働くタンパク質のうち、核コードのものの75%以上が緑藻型である一方、葉緑体コードのものは紅藻型であることが指摘されています。このことから、珪藻の二次共生では緑藻の取り込みと葉緑体化に伴う遺伝情報の核移行の後、間もなく紅藻が取り込まれて緑藻型葉緑体に取って代わったことが示唆されています。この複雑な過程を経て成立した珪藻類の核ゲノムは、恐らく繊毛虫類と考えられる祖先真核宿主ゲノム、緑藻型及び紅藻型の遺伝子とともに、クラミジアやプロテオバクテリア型の遺伝子の水平伝播も受けてモザイク化しています。その結果、珪藻類の炭素代謝系は様々な系統由来の代謝系がオルガネラ間で重複した経路を成し、これらが基質やタンパク質の輸送経路を通じて互いに連携し、既知の真核型の代謝には見られない代謝ネットワークを構成している可能性が示唆されています。
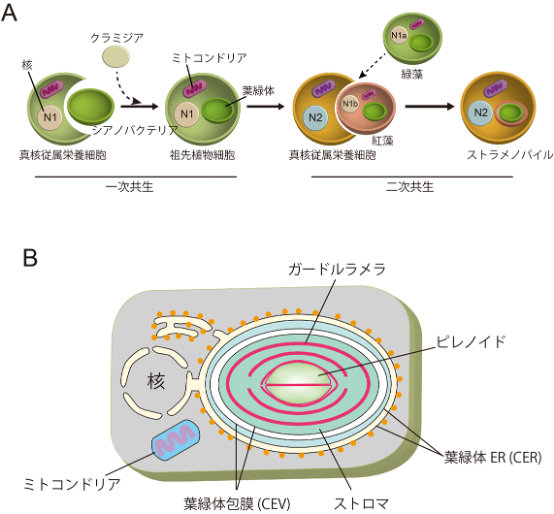
図1.一次共生及び二次共生の過程と珪藻類の葉緑体構造
A, 共生による葉緑体獲得の過程。シアノバクテリアとの共生により真核藻類が誕生し、さらに別の真核細胞と紅藻が共生することによって二次共生藻類が成立した。珪藻類のゲノムから、一次共生時にクラミジアゲノムの取り込み、紅藻の二次共生以前に緑藻の一時的取り込みがあったことが示唆されている (破線矢印)。B, 珪藻類の葉緑体構造。葉緑体は 葉緑体ERと葉緑体包膜の4重膜系で包まれており、葉緑体内にはグラナを形成しない3重チラコイドとなっている。ピレノイドの中心部分を貫通するチラコイドが存在する。
3. 珪藻における無機炭素輸送体
直接的な光合成基質となるCO2が極度に欠乏している海水中でも、海洋性珪藻類が、高い光合成活性を維持していることからも、CO2だけでなくHCO3-も取り込んでいることが示唆されてきました。実際に、これまでの生理学的解析では,海洋性珪藻類は、CO2とHCO3-の両方を取り込む能力を有していることが明らかにされています。しかし、海洋性珪藻類のCO2獲得機構の分子レベルでの解明は、これまで全く進んでいませんでした。珪藻ゲノムには、動物に特有と考えられてきた遺伝子も極めて多く、これは二次共生の最終宿主の核ゲノムに由来するところが大きいと考えられています。このような動物型遺伝子の中には相当数のSolute Carrier (SLC)ファミリータンパク質をコードすると考えられる配列があります。SLCは、ATPの加水分解エネルギーを利用せず細胞内外に物質を輸送する輸送体の総称で、哺乳類においては、51ファミリーに大別され、約378種類の遺伝子が同定されています。このうち、SLC4およびSLC26は、HCO3-輸送体と言われており、このホモログが羽状目型のモデル珪藻、Phaeodactylum tricornutumゲノムにも10遺伝子ほど存在していることがわかりました。そこで、これら遺伝子のCO2濃度変動における発現挙動を調べたところ、SLC4ファミリーに属する3遺伝子が高CO2環境下で完全に転写抑制され、低CO2環境下で顕著に転写誘導されていました。さらに、これら遺伝子産物のC末端部位に緑色蛍光タンパク質、GFPを連結させ、細胞内における局在解析を行ったところ、そのうちの1つが細胞膜に局在していることが明らかとなりました (図2)。このタンパク質を「PtSLC4-2」と命名し、その機能解析を行いました。
微細藻類は一般的に高CO2環境下におくとCCMを大幅に抑制し、無機炭素に対する親和性が極端に低くなります。しかし、上述したGFP融合体PtSLC4-2遺伝子は定常的プロモーターで駆動してあるため、これを発現する形質転換体は、高CO2環境下でもPtSLC4-2を発現し続けることができます。酸素電極1)によって測定した最大光合成速度の半分の速度を与えるHCO3-濃度であるK1/2[HCO3-]値は、高CO2環境下で生育した形質転換体の方で同野生型に比べて1/3程度になり、明らかに高親和性光合成を獲得していることが分かりました。
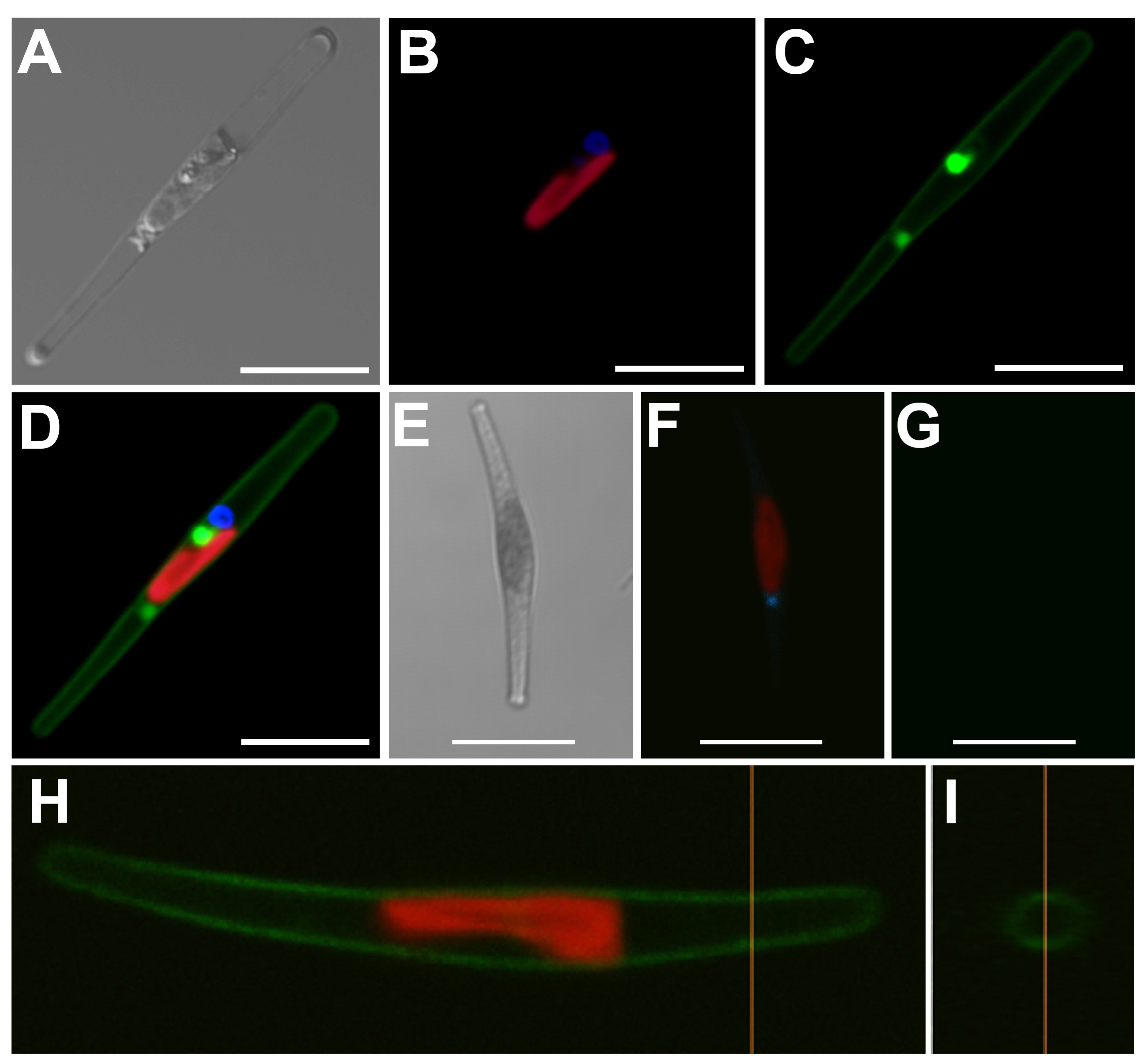
図2. PtSLC4-2の局在解析
PtSLC4-2:GFPを導入した形質転換体(A-D)においては、緑色のGFP蛍光のシグナルが細胞の形に添って局在している。さらに、図Hのオレンジの線の断面図は、円形である(図I)。これらの結果は、PtSLC4-2:GFPが細胞膜に局在していることを示している。一方で、このようなGFP蛍光は野生型細胞では確認できない(E-G)。また、これらの図における青色は、ヘキストによる核染色、赤色は葉緑体の自家蛍光を示している。
次に、PtSLC4-2が実際にHCO3-輸送体として機能しているのかを明らかにすることにしました。今回、私たちは、細胞の無機炭素取り込み能を簡便かつ高感度で測定する方法を新規に開発し、評価を行いました。高CO2環境下で生育させているにもかかわらず、形質転換体は、野生型と比較して、かなり高い無機炭素の取り込み速度を示しました (図3)。
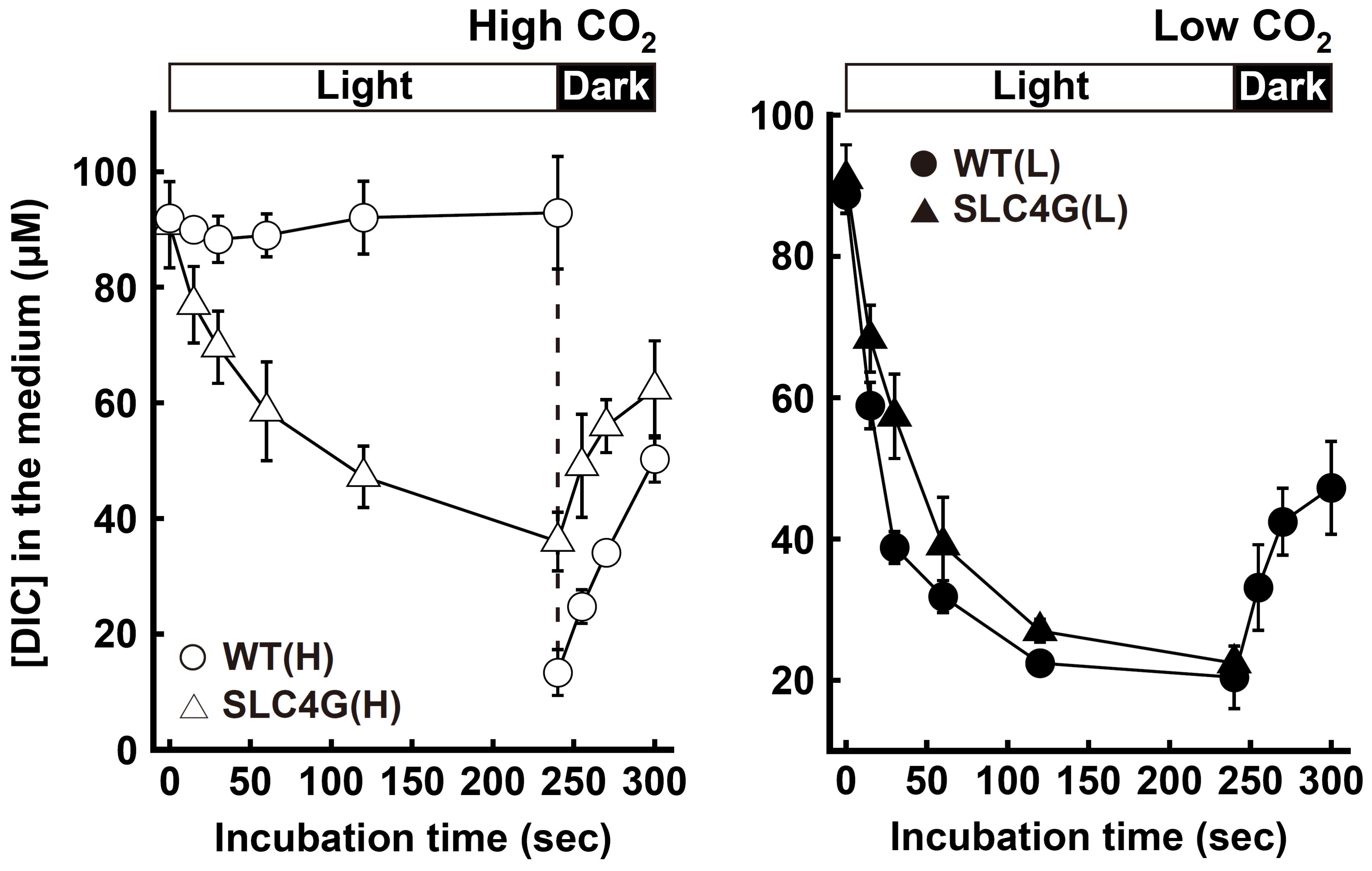
図3.野生型細胞と形質転換体における無機炭素の取り込み速度
高CO2環境下で生育させた野生型細胞(WT)では、無機炭素の取り込みがほとんど起こっていないが、形質転換体(SLC4G)においては、かなり早い速度で無機炭素を取り込んでいることがわかる(左パネル)。一方で、低CO2環境下で生育させた細胞においては、WTとSLC4Gで無機炭素の取り込み速度に顕著な差は見られない(右パネル)。
そこで、どの無機炭素種を積極的に取り込んでいるのかを明らかにするため、取り込み速度を測定する際の測定培地のpHを7.5、8.2、9.5の3種類にすることにしました。溶存無機炭素は、pH変化によってその形態が変化し、典型的な海水のpHである8.2では99%以上がHCO3-の形態で存在します。その結果、高CO2環境下で生育した形質転換体における取り込み速度はpH 8.2の際に最大に達することが明らかとなり、PtSLC4-2は特異的にHCO3-を輸送していることがわかりました (図4A)。さらに、SLC4ファミリータンパク質は、Na+をエフェクター分子としてHCO3-を輸送していることが知られており、PtSLC4-2に関してもNa+をエフェクター分子としてHCO3-を輸送しているのかを検討しました。その結果、PtSLC4-2はNa+濃度依存的にHCO3-の取り込み速度が上昇し、これが高親和性光合成に大きく寄与していることがわかりました (図4B)。また、PtSLC4-2によるHCO3-の取り込みは、Na+の同族元素であるK+やLi+では認められなかったことから、PtSLC4-2は、Na+に対して極めて特異的なHCO3-輸送体であることが確認できました (図4C)。面白いのは、このNa+に対する要求量がこの種の輸送体の中では極めて高いことでした。最大の活性を得るのに100 mM程度の高濃度のNa+を必要とし、これはこれまで知られている藻類型Na+依存性HCO3-輸送体の中では群を抜いて高い値です。ヒトのSLC4ではこの程度の値が記録されており、極めて"好"塩型の輸送体であることが分かりました。
この成果は、海洋真核藻類で初めての無機炭素輸送体同定結果となり、SLC4ファミリー輸送体が海洋光合成の駆動力の一つであることを示す興味深いものとなりました。
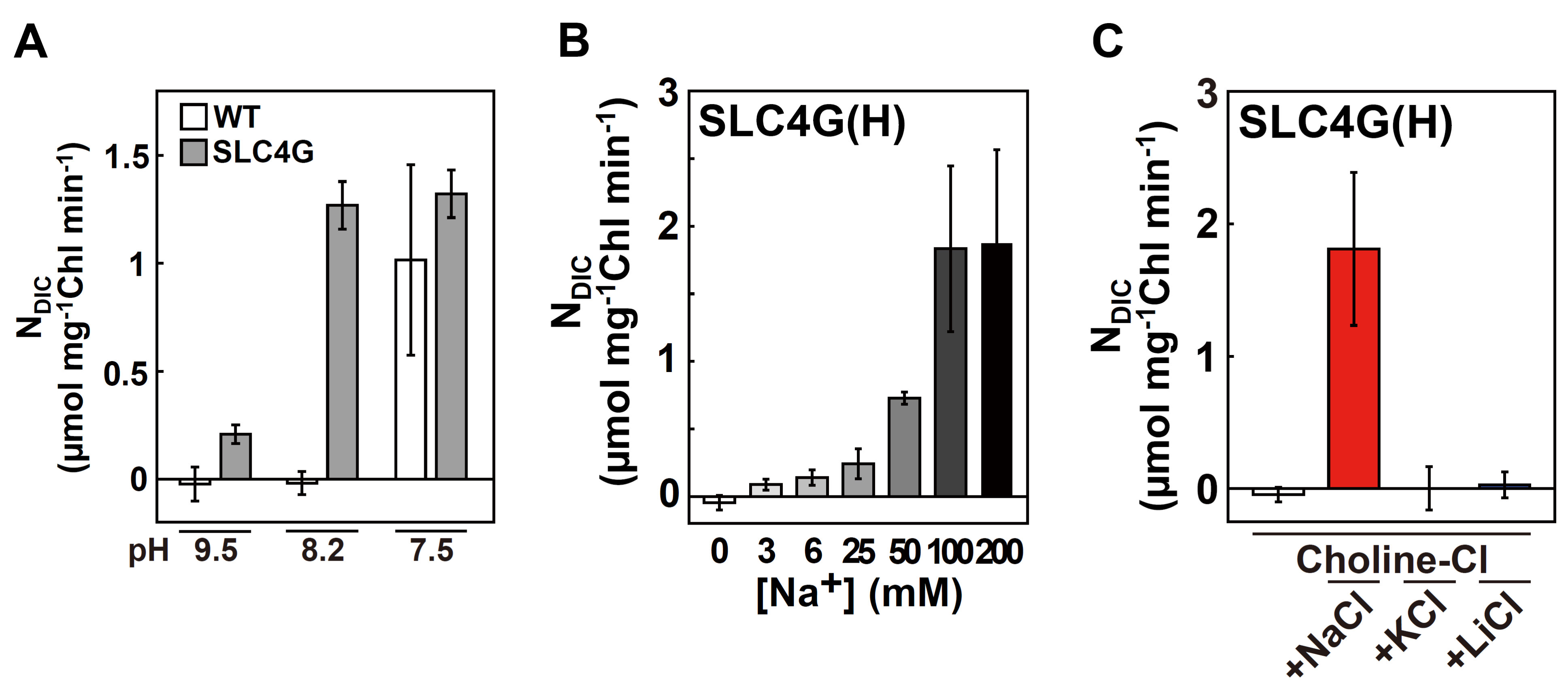
図4.PtSLC4-2のHCO3-特異的輸送とエフェクター分子
これらの実験は、PtSLC4-2:GFPを高発現させた形質転換体(SLC4G)を用いて行った。A, 測定培地のpHを変化させた場合の野生型細胞(WT)と形質転換体(SLC4G)における無機炭素の取り込み速度を比較すると、pH8.2において、WTでは、ほとんど無機炭素の取り込みが起こっていないが、SLC4Gの無機炭素の取り込み速度は最大に達している。B, PtSLC4-2のNa+濃度依存的なHCO3-の取り込みは、約100 mM Na+存在下で最大に達する。C, PtSLC4-2は、Na+添加時にのみHCO3-輸送を行う。
4. 細胞内無機炭素流路と炭酸脱水酵素 (CA)
輸送体を介して獲得したHCO3-は、葉緑体包膜系に局在する未同定の無機炭素輸送体と炭酸脱水酵素 (CA)によって、無機炭素の形態変化を経ながら効率よく葉緑体内へと運ばれると考えられます。CAは、CO2の水和反応を両方向に触媒する酵素で、そのアミノ酸配列からα、β、γ、δ、ε及びζの6つの型に分類されています。αおよびβ型CAは動植物に広く分布していますが、γ型はアーキアやシアノバクテリアなどに見られ、起源の古いCAと考えられてきました。しかし真核生物のミトコンドリアなどにも広く見られるこの配列は活性が認められておらず、γ型はむしろ新しく機能獲得したCAという指摘もあります。ε-CAはシアノバクテリアや化学独立栄養細菌のカルボキシゾームにのみ見られ、一方δおよびζ型は珪藻をはじめとする海洋性のクロミスタ属にのみに見出されています。いずれも進化的系譜があまり分かっていないCAです。これまでに、P. tricornutumのCA候補タンパク質の局在はほぼ網羅されており、葉緑体包膜系に複数のα型CAが局在していることが明らかとなっています。珪藻類の4重包膜は無機炭素通過の際に大きな障壁になると考えられます。従って、チャネルや輸送体がそれぞれの膜に存在しているものと考えられますが、CAによる膜間マトリクスにおけるCO2とHCO3-の迅速な変換は無機炭素流量の調節に極めて重要な役割を担うと考えられます。二次共生藻の4重葉緑体膜の機能は不明な点が多く、また、これら多重膜が進化の途上で退化せず現在まで受け継がれていることから、何らかの重要な機能があるものと私たちは考えています。α型CAの局在はこの点からも非常に興味深い結果だと考えています。
葉緑体内のピレノイドには、RubisCOの他にPtCA1及びPtCA2という2つのβ型CAが局在することが明らかとなっています。この2つのCAはいずれも低CO2環境下で特異的に発現が誘導されるCO2応答性タンパク質であることがわかっています。葉緑体内に取り込まれたHCO3-がピレノイドにおいてCO2へと変換され、RubisCOへと供給されていると考えられ、ピレノイド及びそこに局在するタンパク質はCCMにおいて重要な役割を果たしていると推測されます。しかし、珪藻類のピレノイドはチラコイド膜に四面を接していると考えられるものの、その構造は極めて脆く単離が困難であるために、その生化学的構造や機能については未解明でした。これは珪藻だけでなくその他のピレノイドにも共通して言える、生化学的分析を阻む問題点です。今後これを克服して、ピレノイドの構造と機能の詳細解明が期待されるところです。
5. ピレノイド局在型CAの酸化還元制御
高等植物や緑藻の葉緑体内代謝系の多くは酸化還元状態によって強い制御を受けています。この調節の多くは、光化学系により生じた還元力をフェレドキシン(Fd)、チオレドキシン(Trx)という酸化還元タンパク質を介して標的酵素に伝達し、この還元力でジスルフィド結合の開裂を行うことにより酵素活性を調節する、Fd-Trx系を介しており、その標的はカルビン回路をはじめ、窒素同化、脂肪酸合成、デンプン合成など多岐にわたります。高等植物の葉緑体においては、f、m、x、y及びzのTrxサブタイプが存在しています。これらの標的葉緑体タンパク質数は、多くの機能未知タンパク質を含めて300を超えることがわかっており、Trxが極めて広範な葉緑体代謝制御因子であることが窺えます。一方、珪藻では、f、m、y型Trxが葉緑体に局在しているものの、カルビン回路に関わるほとんどの酵素が酸化還元制御を受けていないことが知られており、珪藻カルビン回路における酸化還元制御の役割は緑色植物に比べて小さいものと考えられています。同時に、珪藻葉緑体におけるTrxや酸化還元制御の標的が何であるのかは、ほとんどわかっていない、興味深い話題です。
私たちは、最近の研究で、珪藻葉緑体型TrxがPtCA1及びPtCA2を標的として分子内ジスルフィド結合の還元により活性化していることを示しました。PtCA1及びPtCA2の成熟タンパク質を大腸菌体内で発現し、シロイヌナズナ由来の2種の葉緑体型Trx及びP. tricornutum由来の2種の葉緑体型Trx存在下、及び非存在下でCA活性を比較しました。その結果、Trxと電子供与体としてDTTを共添加したときにCA活性が大幅に上昇したことから、PtCA1及びPtCA2がTrxの標的酵素の一つであり、還元により活性化されることが示されました (図5A, B)。また、シロイヌナズナから得た葉緑体型AtTrxsよりP. tricornutumから得た葉緑体型PtTrxsの方がPtCAに対して親和性が高く、相互作用が生物種特異的に最適化されていることも強く示唆されています (図5C, D)。2つのPtCAには、活性部位である亜鉛リガンド構成因子のシステイン (Cys) の他に、機能不明な2つのCys残基があり、これらを一つずつセリン (Ser)残基に置換した変異体を作製し、酸化及び還元環境下におけるCA活性の測定及び非還元SDS-PAGEを行いました。その結果、いずれの変異体においても酸化状態における不活性化が見られなくなりました。このことから、PtCA1の105および166番目のCys残基、及びPtCA2の102および163番目のCys残基間で分子内ジスルフィド結合を形成することにより、CAが不活性化されることがわかりました。PtCA活性を基準に測定した酸化還元電位はどちらのCAも約-370 mVであり、CAの電子供与体としてはFdが機能していることが示唆されています。これは、海洋性珪藻においてピレノイド内の代謝がFd-Trx系による酸化還元制御を受けていることを示しています。
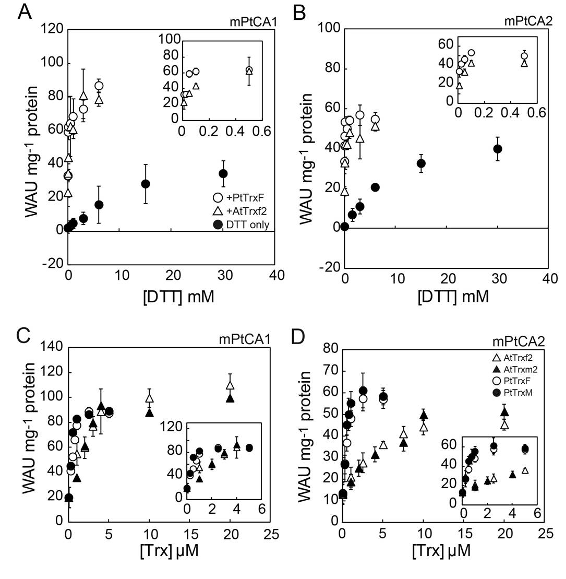
図5.PtCA1及びPtCA2のTrx依存的活性化
A, B, 50 µM 塩化銅で酸化したPtCA1 (A) 及びPtCA2 (B) をシロイヌナズナ由来又は珪藻由来のTrx存在下及び非存在下でDTTと反応させ、そのCA活性を測定した。C, D, 6 mM DTT存在下でPtCA1 (C) 及びPtCA2 (D) を様々な濃度のTrxと反応させ、そのCA活性を測定した。
また、葉緑体内での2つのPtCAの酸化因子を探索するため、還元型PtCAsを様々な酸化剤と反応させてCA活性を調べました (図6)。その結果、分子酸素によってのみ不活性化が見られました。この特異性は高く、かなりの高濃度の酸化型アスコルビン酸、酸化型グルタチオン或いは過酸化水素でも不活性化は起きませんでした (図6)。これらのことから、PtCA1及びPtCA2は、大気レベル以上の酸素分圧で不活性化され、葉緑体内の還元型Trxにより活性化されることが示されました。
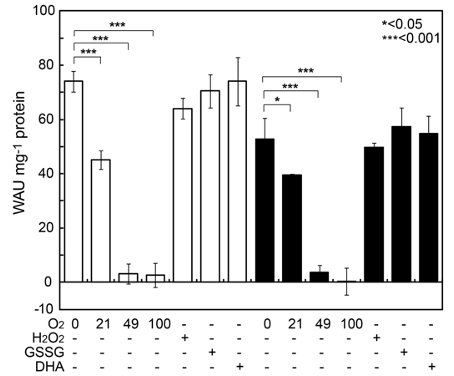
図6.様々な酸化剤のPtCAs活性への影響
還元処理を行ったPtCA1(白)及びPtCA2(黒)を0% O2、21% O2、49% O2、100% O2、100 µM H2O2、2 mM 酸化型グルタチオン及び500 µM酸化型アスコルビン酸と反応させ、そのCA活性を測定した。
これらの結果は、PtCAsが光化学系IIで生じる酸素により酸化され、不活性化される一方で、光化学系Iから電子を受け取ったFdからの還元力によりTrxを介して還元されて活性化されるというように、その活性が光化学系I、IIのエネルギー状態に応じて常に微調整されて最適な状態に保たれていることを示しています (図7)。同時に、珪藻葉緑体Trxの主要な標的分子の一つが炭酸固定系ではなく、ピレノイドにおけるCO2濃縮及び供給系であることを強く示唆するものとなっています。
6. おわりに
今回、珪藻類の成り立ちの概要と、海洋性珪藻の無機炭素濃縮系に関する私たちの研究成果の一部を紹介しました。細胞膜HCO3-輸送体、無機炭素流路調節に関与すると考えられるCA、及びピレノイドの機能の一端が分子レベルで明らかになりつつあります。しかし、無機炭素輸送システム、ピレノイド構成因子の詳細と機能については未解明な点が多くあります。珪藻類においては、外来遺伝子の導入やRNA干渉法による遺伝子発現の特異的抑制が可能になりましたが、相同組換え技術が確立していないなど分子生物学的研究はまだ発展途上にあります。しかし技術の発展は極めて速く、現在すでにメガヌクレアーゼを用いた新たな技術が様々な2倍体生物の遺伝子ノックアウトに使われるようになってきました。このような技術を駆使することで、これまで分子研究がなかなか出来なかった様々な植物の研究発展が期待されます。珪藻のCCMやその制御などについても、今後の加速的な研究発展を期待している次第です。
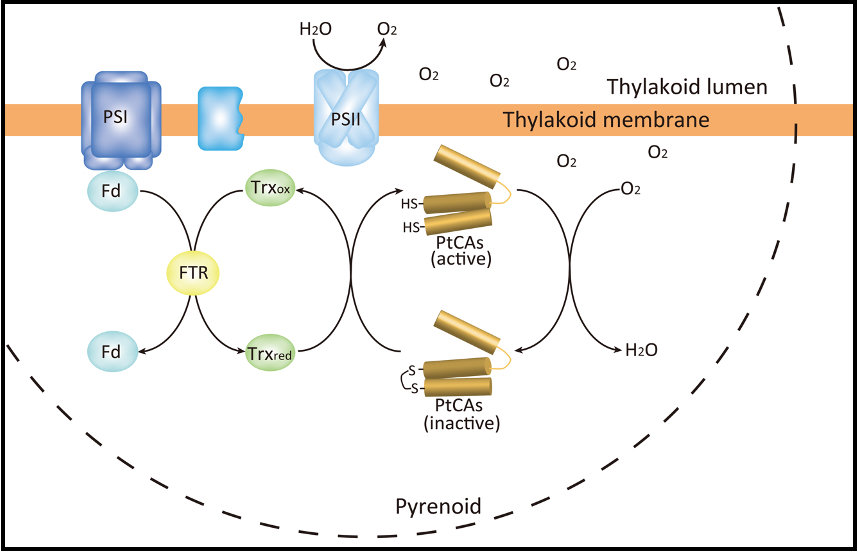
図7.葉緑体内で予想されるPtCA1,2の酸化還元制御モデル.
Fd: フェレドキシン,FTR: フェレドキシン-チオレドキシン レダクターゼ,Trx: チオレドキシン.
用語説明
1) 酸素電極:銀などのような参照電極と貴金属で出来た作用電極を用いた電解分析用電極の一種であり、二極間の電位差変化を追跡することで、反応物質の濃度測定を行うことが可能。反応物質として酸素を対象としたものを酸素電極と呼ぶ。
文献
Nakajima K, Tanaka A, Matsuda Y (2013) SLC4 family transporters in a marine diatom directly pump bicarbonate from seawater. Proc Natl Acad Sci USA 110: 1767-1772
Kikutani S, Tanaka R, Yamazaki Y, Hara S, Hisabori T, Kroth PG, Matsuda Y (2012) Redox regulation of carbonic anhydrases via thioredoxin in chloroplast of the marine diatom Phaeodactylum tricornutum. J Biol Chem 287: 20689-20700
Tachibana M, Allen AE, Kikutani S, Endo Y, Bowler C, Matsuda Y (2011) Localization of putative carbonic anhydrases in two marine diatoms, Phaeodactylum tricornutum and Thalassiosira pseudonana. Photosynth Res 109: 205-221
記事・写真・図版などの無断転載を禁じます。